3 Pagrindiniai veiksniai, turintys įtakos Joniškos obligacijos formavimui
Kai kurie pagrindiniai veiksniai, darantys įtaką joninių jungčių susidarymui, yra šie:
Jonų ryšį sudaro vienas ar daugiau elektronų pernešimas iš vieno atomo išorinio energijos apvalkalo (valencinio apvalkalo) į kito atomo išorinį energijos apvalkalą. Tokiu būdu abu atomai įsigyja stabilias artimiausio kilno atomo elektronines konfigūracijas. Atomas, iš kurio perduodami elektronai, ty atomas, kuris praranda elektronus, įgyja teigiamą krūvį ir tampa katijonu.
Atomumas, kuris gauna elektronus, įgyja neigiamą krūvį ir tampa anijonu. Elektrostatinis pritraukimas tarp priešingai užkrautų jonų lemia jonų jungties arba elektrovalentinio ryšio tarp dviejų atomų susidarymą, o junginiai vadinami joniniais junginiais arba elektrovalentiniais junginiais, pvz.
Veiksniai, turintys įtakos Joniškos obligacijos formavimui:
1. Jonizacijos energija:
Jis apibrėžiamas kaip energijos kiekis, reikalingas labiausiai laisvai susietam elektronui pašalinti iš izoliuoto elemento dujinio atomo. Kuo mažesnė jonizacijos energija, tuo didesnis yra katijono susidarymo paprastumas.
2. Elektronų afinitetas:
Jis apibrėžiamas kaip energijos kiekis, atpalaiduojamas, kai elektronas pridedamas prie izoliuoto elemento dujinio atomo. Kuo didesnė energija išleidžiama per šį procesą, tuo lengviau susidarys anijonas.
Taigi, metalo atomo maža jonizacijos energija ir aukštas ne metalo atomo elektronų afinitetas palengvina jonų ryšį tarp jų.
3. Grotelių energija:
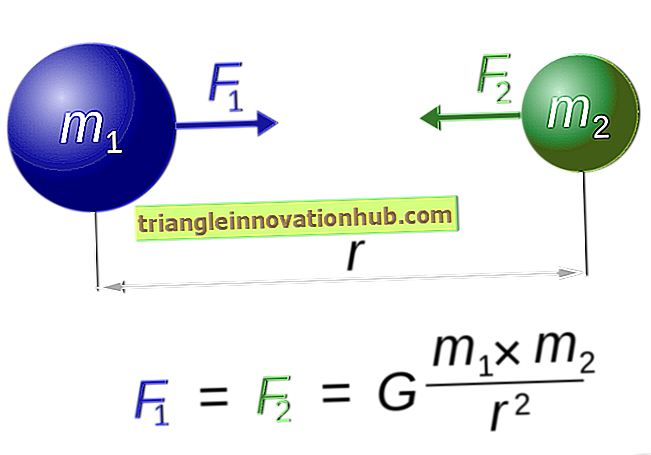
Jis apibrėžiamas kaip energijos kiekis, atpalaiduojantis, kai katijonai ir anijonai yra perkeliami iš begalybės į jų atitinkamas pusiausvyros vietas kristalų grotelėse, kad susidarytų vienas molinis jonų junginys. Kuo didesnė grotelių energija, tuo didesnė yra joninės jungties susidarymo tendencija. Kuo didesnis jonų įkrovimas ir mažesnis atstumas tarp jų, tuo didesnė jų traukos jėga.